Vipoglanstat hämmar selektivt och säkert mPGES-1
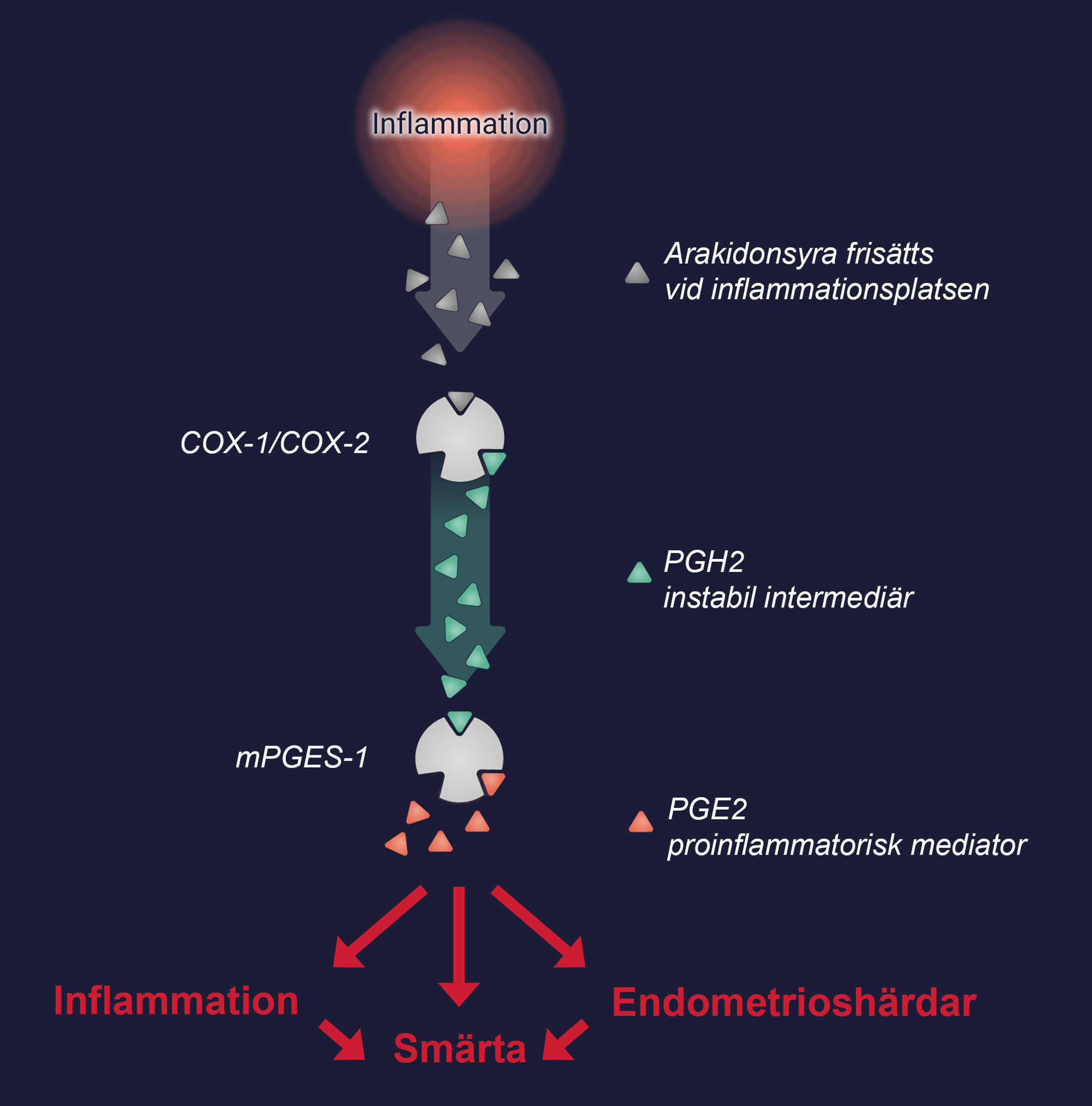
Gesynta Pharma utvecklar vipoglanstat (GS-248) – en läkemedelskandidat med en unik förmåga att effektivt och selektivt hämma mikrosomalt prostaglandin E-syntas-1 (mPGES-1) Detta enzym har visat sig spela en nyckelroll inte bara i smärta och inflammation generellt, utan även mer specifikt vid endometrios.
Enzymet mPGES-1 är en viktig del av den komplexa arakidonsyrakaskaden, som reglerar många fysiologiska och sjukdomsframkallande processer genom bildning av mediatorer (signalsubstanser) med kraftfulla biologiska effekter i kringliggande vävnader. I denna kaskad uppregleras mPGES-1 specifikt för att katalysera produktionen av det proinflammatoriska prostaglandin E2 (PGE2), vilket är välkänt för att mediera smärta och inflammation vid ett brett spektrum av kroniska inflammatoriska sjukdomar, inklusive endometrios. Det har visats att endometrios-härdar (inflammatorisk vävnad som liknar livmoderslemhinnan och växer utanför livmodern huvudsakligen i bäckenområdet) innehåller höga nivåer av mPGES-1, vilket leder till ökad produktion av PGE2. Detta bekräftas av fyndet av förhöjda PGE2-nivåer i bukhålan hos patienter med endometrios. PGE2 orsakar inte bara smärta och inflammation vid endometrios utan spelar även en nyckelroll i utvecklingen av endometrioshärdar. Effekten av PGE2 anses medieras genom stimulering av lokal östrogenproduktion och genom att stimulera frisättningen av VEGF (vascular endothelial growth factor Både östrogen och angiogenes är av stor betydelse för endometrioshärdarnas tillväxt.
Sammanfattningsvis förväntas hämning av mPGES-1 begränsa inflammationen och minska tillväxten av endometrioshärdar genom att reducera produktionen av proinflammatorisk PGE2.
Utveckling av vipoglanstat för behandling av endometrios
I en preklinisk studie har vipoglanstat uppvisat mycket god effekt i en avancerad sjukdomsmodell för endometrios. Resultaten visar att läkemedelskandidaten markant minskar antalet endometrioshärdar samt har en positiv inverkan på smärtrelaterade parametrar och välmående. Effekten på endometrioshärdarna visar att vipoglanstat har en sjukdomsmodifierande effekt.
Vipoglanstat har genomgått kliniska studier såväl i friska försökspersoner som i patienter med kronisk inflammatorisk sjukdom. Resultaten visar att vipoglanstat kan administreras oralt på ett patientvänligt sätt och snabbt når terapeutiska nivåer i blodet. Behandling med vipoglanstat har visat sig leda till en fullständig hämning av mPGES-1 i patienter med kronisk inflammation. Inga allvarliga biverkningar observerades under fyra veckors behandling och läkemedelskandidaten tolererades väl av patienterna.
De tydliga resultaten från den prekliniska proof-of-concept-studien med vipoglanstat ger starkt stöd för dess smärtlindrande och sjukdomsmodifierande egenskaper. Detta, tillsammans med data från tidigare kliniska studier av läkemedelskandidatens säkerhetsprofil, farmakokinetiska egenskaper och förmåga att hämma målenzymet mPGES-1, utgör en solid vetenskaplig bas för den fortsatta utvecklingen av vipoglanstat som en effektiv icke-hormonell behandling av endometrios. En klinisk fas II-studie i patienter med endometrios förbereds nu.
Exklusivitetsskydd
Gesynta Pharma har beviljats substanspatent (composition of matter) för vipoglanstat i USA, Europa, Kina, Japan och på flera andra viktiga marknader. Utöver dessa redan godkända patent har bolaget under 2022 lämnat in en patentansökan för användningen av vipoglanstat inom endometrios för att ytterligare stärka och förlänga det immaterialrättsliga skyddet.
Andra indikationer: GS-073
Utöver vipoglanstat innehåller Gesynta Pharmas utvecklade pipeline mPGES-1-hämmaren GS-073. Denna läkemedelskandidat är redo att gå in i klinisk utveckling för behandling av kronisk inflammatorisk smärta, ett område med stora medicinska behov. Gesynta Pharma har tagit fram komplett preklinisk säkerhetsdokumentation och studieprotokoll för GS-073.
Läkemedelskandidaten har visat mycket goda resultat på både inflammation och smärta i en preklinisk sjukdomsmodell av artrit (kronisk ledinflammation). Det primära syftet med den planerade första fas I-studien är att studera säkerhet och tolerabilitet av GS-073 i friska försökspersoner. Farmakokinetiska egenskaper och effekt på relevanta biomarkörer kommer också att studeras, vilket ger viktig kunskap inför planering av det fortsatta kliniska programmet.